La terre est riche d'une diversité chimique exceptionnelle. On y trouve des molécules chimiquement simples, formées de seulement deux atomes, comme le dihydrogène (H2) jusqu'à des molécules géantes combinant des milliers d'atomes telles que l'ADN en passant par des cristaux de toutes sortes, etc. Cette diversité est trompeuse. A l'échelle de l'univers deux éléments règnent sur les composants chimiques, l'hydrogène et l'hélium, le reste ne représente qu'une infime fraction laborieusement formée dans les étoiles massives depuis plus de 13 milliards d'années. Plus de 99% des atomes de l'univers (75% d'hydrogène et 25% d'hélium en fraction de masse) ont été formés pendant la nucléosynthèse primordiale qui date des trois premières minutes de l'univers.
Avant d'en venir à la nucléosynthèse primordiale, un rapide bilan des connaissances sur les atomes et leur structure est entrepris.
Historique
Tableau de Mendeleïev
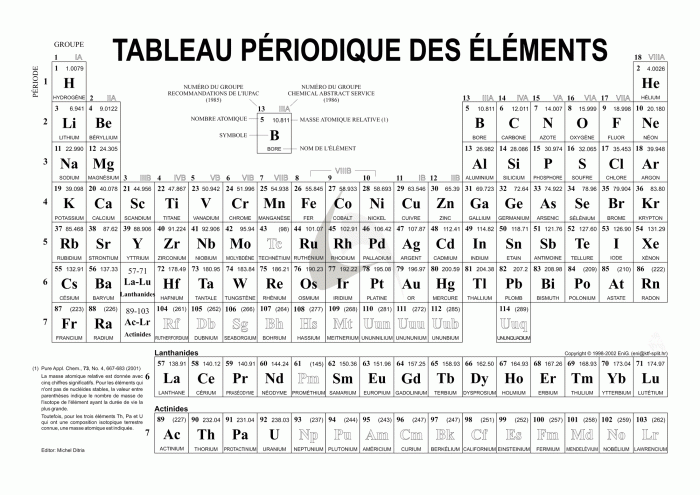
Tableau périodique des éléments. Ce tableau classe les atomes par leurs nombres d'électrons.
Crédit :
Fururama Sciences
Vision classique de l'atome
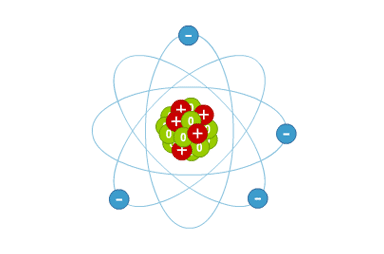
Vision classique de l'atome. Les protons sont représentés en rouge, les neutrons en vert et les électrons en bleu. L'échelle des tailles n'est pas respectée car le taille du noyau atomique est près de 1000 fois plus petite que la distance entre le centre et les électrons.
Le terme atome a été utilisé, au XIXe siècle, pour désigner des particules qui ne peuvent se casser, du grec a-tomos. A cette époque, on croyait avoir découvert les briques élémentaires de la physique, classées dans le célèbre tableau de Mendeleïev. Le XXe siècle a cassé cette vision. Les atomes sont en vérité constitués de protons, de neutrons et d'électrons.
Propriétés des constituants atomiques
| Masse | Charge |
| Proton | 1,672.10-27 | e |
| Neutron | 1,674.10-27 | 0 |
| Électron | 9,1.10-31 | -e |
Isotopes
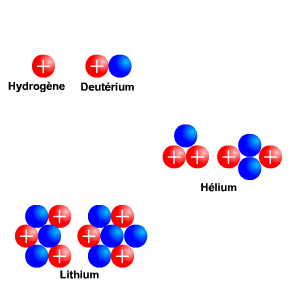
Exemples d'isotopes pour les atomes légers. Les billes bleues représentent les neutrons et les rouges les protons. Le noyau d'hydrogène (H) et son isotope le deutérium (D ou 2H). De même pour l'hélium (3He et 4He) et le lithium (6Li et 7Li).
Crédit :
ASM
Les isotopes
Les neutrons, comme leur nom l'indique, sont électriquement neutres. Les protons ont eux une charge positive +e (+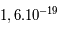 Coulomb) alors que l'électron a une charge négative de -e, l'exact opposé. Ainsi, pour qu'un atome soit neutre, il faut qu'il y ait autant de protons que d'électrons. Le nombre de neutrons n'est pas contraint pour la neutralité ; cependant il est défini afin que le noyau soit le plus stable possible. Les petits noyaux (hélium, carbone, azote) ont autant de neutrons que de protons tandis que les noyaux plus massifs (Uranium) ont un excès de neutrons. Le nom de l'atome est déterminé par son nombre de proton. Ainsi un atome de carbone a 6 protons et un atome de Fluor 9, etc. Deux atomes ayant le même nombre de protons mais un nombre différent de neutrons sont appelés des isotopes, du grec iso (même) et topos (lieu dans le tableau périodique). Seule leur masse totale change. Parmi les isotopes d'un atome, certains sont stables tandis que d'autres subissent des réactions nucléaires de désintégrations qui les transforment en un nouvel atome stable. L'exemple le plus connu est l'isotope
Coulomb) alors que l'électron a une charge négative de -e, l'exact opposé. Ainsi, pour qu'un atome soit neutre, il faut qu'il y ait autant de protons que d'électrons. Le nombre de neutrons n'est pas contraint pour la neutralité ; cependant il est défini afin que le noyau soit le plus stable possible. Les petits noyaux (hélium, carbone, azote) ont autant de neutrons que de protons tandis que les noyaux plus massifs (Uranium) ont un excès de neutrons. Le nom de l'atome est déterminé par son nombre de proton. Ainsi un atome de carbone a 6 protons et un atome de Fluor 9, etc. Deux atomes ayant le même nombre de protons mais un nombre différent de neutrons sont appelés des isotopes, du grec iso (même) et topos (lieu dans le tableau périodique). Seule leur masse totale change. Parmi les isotopes d'un atome, certains sont stables tandis que d'autres subissent des réactions nucléaires de désintégrations qui les transforment en un nouvel atome stable. L'exemple le plus connu est l'isotope 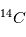 (carbone 14), un noyau de carbone avec 6 protons (donc du carbone), 6 électrons pour être neutre, et 8 neutrons. Cet atome instable se transforme au bout d'un temps caractéristique de 6 000 ans, en
(carbone 14), un noyau de carbone avec 6 protons (donc du carbone), 6 électrons pour être neutre, et 8 neutrons. Cet atome instable se transforme au bout d'un temps caractéristique de 6 000 ans, en 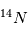 (sept protons et sept neutrons). Une réaction nucléaire change un neutron en un proton en éjectant un électron pour conserver la charge électronique totale. Cet isotope existe encore sur terre même après des milliards d'années d'évolution séculaire car il est régénéré par les rayons cosmiques qui frappent quotidiennement la terre, changeant un atome d'azote en carbone 14. Lorsqu'un corps meurt, il devient un système fermé sans échange avec l'extérieur et alors son rapport entre le
(sept protons et sept neutrons). Une réaction nucléaire change un neutron en un proton en éjectant un électron pour conserver la charge électronique totale. Cet isotope existe encore sur terre même après des milliards d'années d'évolution séculaire car il est régénéré par les rayons cosmiques qui frappent quotidiennement la terre, changeant un atome d'azote en carbone 14. Lorsqu'un corps meurt, il devient un système fermé sans échange avec l'extérieur et alors son rapport entre le 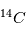 et le
et le 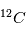 ne cesse de décroître par désintégration. La mesure du rapport permet de déterminer à quelle date l'être vivant est mort. Cela est très utilisé pour déterminer l'âge des momies. Cette méthode ne peut permettre des datations plus anciennes que quelques dizaines de milliers d'années car après cela tout le
ne cesse de décroître par désintégration. La mesure du rapport permet de déterminer à quelle date l'être vivant est mort. Cela est très utilisé pour déterminer l'âge des momies. Cette méthode ne peut permettre des datations plus anciennes que quelques dizaines de milliers d'années car après cela tout le 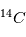 est désintégré.
est désintégré.
Les ions
Les atomes sont par définition neutres, cependant des réactions chimiques peuvent faire qu'un atome gagne ou perde un électron. L'atome résultant devient un ion, négatif s'il a gagné un électron, positif s'il en a perdu un. Étant chargé, un ion aura tendance à fortement interagir avec une autre particule chargée de signe contraire pour reformer un élément neutre ; un atome ou une molécule.
Proportions des éléments dans l'univers
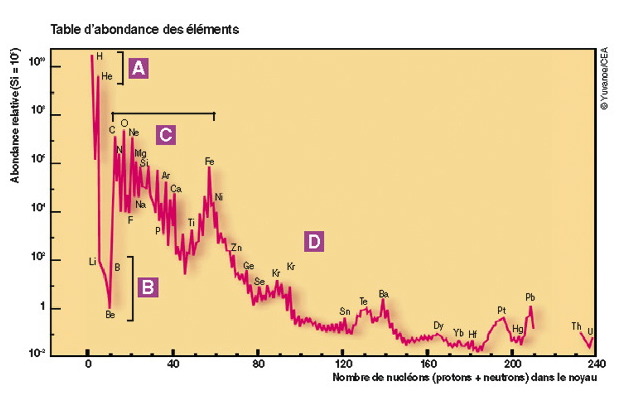
Abondance des éléments chimiques dans l'Univers rapportée à celle du silicium (Si), prise arbitrairement à
.
Crédit :
CEA
La chimie moléculaire
Où trouve-t-on des molécules dans l'espace ? Sur Terre, il existe des milliers de molécules différentes ; de simples molécules comme le dihydrogène dans l'air, H2, à des molécules géantes telles que l'ADN. De même, les autres planètes telluriques mais aussi les planètes gazeuses contiennent des molécules. Des molécules assez simples (moins d'une dizaine d'atomes) se trouvent aussi dans les nuages moléculaires (CO, HCN, ...). Les masse volumiques atteintes dans ces régions permettent de refroidir le gaz et de créer assez de collisions pour assembler des molécules. On trouve même des molécules d'eau, H20, jusqu'aux confins de l'univers (dans l'environnement de noyaux actifs de galaxies très distantes). Il peut paraître surprenant de trouver des molécules à la surface de certaine étoiles. Cependant, bien que les étoiles soient des environnements très chauds et donc impropres à conserver des molécules stables, les étoiles les plus froides 2 000 - 3 000 K (les étoiles K et surtout M) peuvent héberger des molécules simples sans les casser par collisions.
Bien que l'on trouve des molécules dans divers endroits de l'univers, leur masse totale est négligeable comparée à la masse totale des éléments chimiques de l'univers.
La chimie des métaux
Les métaux en astrophysique englobent tous les éléments plus lourds que l'hélium. Il est assez facile d'en détecter dans les nuages de gaz galactique peu denses et chauds, par leur raies d'absorption ou d'émission. Certaines raies du calcium, de l'oxygène ou du fer ionisés sont maintenant bien connues et étudiées. De manière similaire, les métaux sont aussi visibles par les raies d'absorption qu'ils génèrent dans le spectre d'une étoile.
Bien que la totalité des métaux soit plus massifs que les molécules, ils ne représentent toujours qu'une infime partie de la masse totale de l'univers, moins de 1%.
Hydrogène et Hélium
Les éléments qui forment l'écrasante majorité de la matière ordinaire dans l'univers sont l'hydrogène, à près de 75% de la masse, et l'hélium à près de 24%. Ces deux éléments se retrouvent presque partout. Les étoiles en sont remplies et s'en servent comme carburant pour leurs réactions thermonucléaires. Les nuages interstellaires et intergalactiques sont des réservoirs de gaz qui pourront potentiellement se transformer partiellement en étoiles. Seules les zones de très fortes masse volumiques et froides sont moins fournies en hydrogène et en hélium. La terre par exemple n'a que peu d'hydrogène et d'hélium dans son atmosphère comparé à l'azote et l'oxygène. L'hélium fut ainsi découvert non pas sur terre mais sur le soleil en essayant d'expliquer ses raies d'absorption ; hélium vient de hélios, le Soleil en grec.
L'hydrogène et l'hélium ne peuvent pas s'être formés dans les étoiles comme pour les autres atomes car c'est justement l'endroit où ils sont détruits, fusionnés pour former les métaux. Très vite les modèles de Big Bang ont prédit une production de ces atomes dans les premiers instants de l'univers quand les températures étaient bien plus élevées que dans les étoiles. Cette période de formation des atomes légers, hydrogène, hélium (3He et 4He) mais aussi du deutérium (D ou 2H) et du Lithium 7 s'appelle la nucléosynthèse primordiale, à différencier de celle stellaire actuellement en cours dans les étoiles. Elle s'est déroulée près de trois minutes après le Big Bang.
L'univers avant cette nucléosynthèse primordiale avait une température de  K et était un plasma. On est bien avant l'époque de la recombinaison. La matière se divisait en deux catégories : les protons (87% de la masse) et les neutrons (13% de la masse). Du deutérium et du tritium pouvaient se former mais ils étaient instables du fait des collisions et de l'énergie des photons qui existaient à cette époque.
K et était un plasma. On est bien avant l'époque de la recombinaison. La matière se divisait en deux catégories : les protons (87% de la masse) et les neutrons (13% de la masse). Du deutérium et du tritium pouvaient se former mais ils étaient instables du fait des collisions et de l'énergie des photons qui existaient à cette époque.
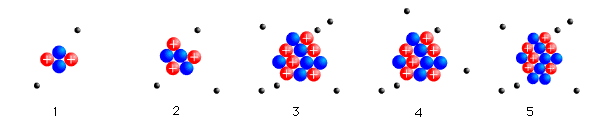
Réaction de formation de l'hélium
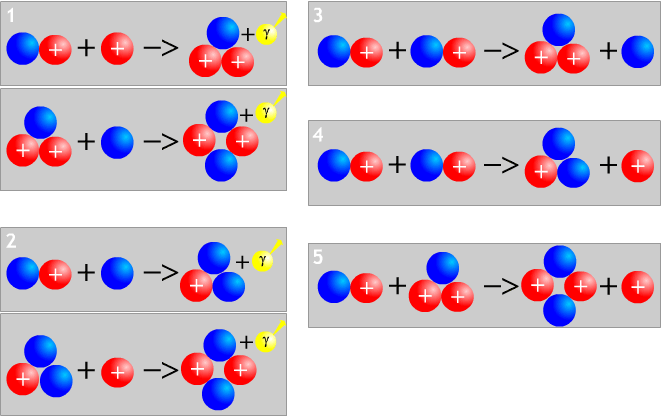
Réactions de synthèse de l'hélium, en bleu les neutrons, en rouge les protons, en jaune les photons.
Crédit :
Astrophysique sur Mesure / Florence Durret, Fabienne Casoli et Gilles Bessou
Réaction de formation du deutérium
Le deutérium est formé par l'addition d'un proton et d'un neutron. Au dessus d'un milliard de Kelvins, il est instable car des photons peuvent facilement le dissocier.
p + n 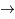 D +
D +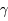 , où
, où 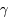 est un photon résultant de la réaction.
est un photon résultant de la réaction.
Proportion des atomes légers
La nucléosynthèse a commencé près de trois minutes après le Big Bang quand les protons représentaient 87% de la matière et quand les neutrons en représentaient 13%. Cette dissymétrie est due au fait qu'un neutron libre est instable et se transforme en proton avec un temps caractéristique de 10 min. La quasi-totalité des neutrons a servi à créer des noyaux d'hélium. Cela conduit à une masse d'hélium comprenant les 13% de neutrons ainsi que 13% de protons pour faire des noyaux d'hélium (2 protons, 2 neutrons). Le tout comprend 26% de la masse totale. Les 74% restant sont des protons qui formeront ultérieurement les atomes d'hydrogène à l'époque de la recombinaison.
Les trois minutes de la nucléosynthèse primordiale
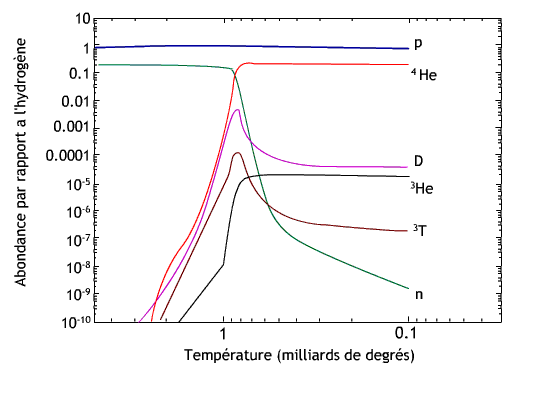
L'abondance des éléments pendant les premières minutes de l'Univers, par rapport à celle des protons.
Crédit :
E. Vangioni-Flam, IAP
Après l'hélium 4 (deux neutrons, deux protons), qui est un noyau particulièrement stable, le processus de construction des noyaux par addition d'un neutron ou d'un proton tourne court. En effet, il n'existe pas de noyau stable de masse 5. Pour sauter le pas, il faudrait fusionner de l'hélium avec du deutérium ou un autre noyau d'hélium, mais à cause de l'expansion de l'Univers, température et masse volumique ne sont plus suffisantes pour vaincre la répulsion entre les noyaux chargés positivement. C'est un goulot d'étranglement de la nucléosynthèse.
Pendant la nucléosynthèse primordiale, il se forme donc extrêmement peu d'éléments plus lourds que l'hélium, juste un peu de lithium (7Li) et de béryllium (7Be). Il n'y a pas de noyau stable de masse 8, ce qui forme un nouveau goulot d'étranglement pour la formation nucléaire.
La figure ci-contre représente l'évolution des éléments légers pendant la nucléosynthèse. L'axe des abscisses est la température en unités de milliards de degrés : à t = 1 s, la température est de 15 milliards de degrés. En trois minutes, elle diminue à 1,1 milliard de degrés. Au début de la nucléosynthèse, l'Univers ne contient que des protons et des neutrons. Trois minutes après, le paysage s'est considérablement enrichi, et presque tous les neutrons ont été consommés pour fabriquer des noyaux d'hélium 4. Les autres neutrons vont rapidement disparaître car les neutrons libres (en dehors d'un noyau) sont instables avec un temps de demi-vie de 10 minutes, ils se transforment alors en protons.


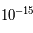 m). Les électrons sont liés par la force électromagnétique et "orbitent" autour du noyau atomique. Le terme "orbiter" comme pour les planètes est faux mais bien commode. Pour bien appréhender l'électron, il faudrait utiliser la mécanique quantique, parler d'onde de probabilité et de quantification de l'énergie, etc. Pour ce cours, on supposera que toutes les particules sont des billes très petites ; la vérité est plus complexe mais cette simplification est suffisante pour notre propos. Les électrons orbitent donc à une distance de
m). Les électrons sont liés par la force électromagnétique et "orbitent" autour du noyau atomique. Le terme "orbiter" comme pour les planètes est faux mais bien commode. Pour bien appréhender l'électron, il faudrait utiliser la mécanique quantique, parler d'onde de probabilité et de quantification de l'énergie, etc. Pour ce cours, on supposera que toutes les particules sont des billes très petites ; la vérité est plus complexe mais cette simplification est suffisante pour notre propos. Les électrons orbitent donc à une distance de 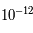 m du noyau. Les masses du proton et du neutron sont sensiblement les mêmes,
m du noyau. Les masses du proton et du neutron sont sensiblement les mêmes, 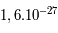 kg, alors que celle de l'électron est de l'ordre de
kg, alors que celle de l'électron est de l'ordre de 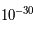 kg ; l'électron est donc 1800 fois moins massif qu'un proton. Cela entraîne qu'un atome est constitué d'un noyau très dense contenant 99.99 % de la masse autour duquel orbitent des électrons de masses négligeables. Un atome est donc principalement constitué de vide.
kg ; l'électron est donc 1800 fois moins massif qu'un proton. Cela entraîne qu'un atome est constitué d'un noyau très dense contenant 99.99 % de la masse autour duquel orbitent des électrons de masses négligeables. Un atome est donc principalement constitué de vide.

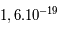 Coulomb) alors que l'électron a une charge négative de -e, l'exact opposé. Ainsi, pour qu'un atome soit neutre, il faut qu'il y ait autant de protons que d'électrons. Le nombre de neutrons n'est pas contraint pour la neutralité ; cependant il est défini afin que le noyau soit le plus stable possible. Les petits noyaux (hélium, carbone, azote) ont autant de neutrons que de protons tandis que les noyaux plus massifs (Uranium) ont un excès de neutrons. Le nom de l'atome est déterminé par son nombre de proton. Ainsi un atome de carbone a 6 protons et un atome de Fluor 9, etc. Deux atomes ayant le même nombre de protons mais un nombre différent de neutrons sont appelés des isotopes, du grec iso (même) et topos (lieu dans le tableau périodique). Seule leur masse totale change. Parmi les isotopes d'un atome, certains sont stables tandis que d'autres subissent des réactions nucléaires de désintégrations qui les transforment en un nouvel atome stable. L'exemple le plus connu est l'isotope
Coulomb) alors que l'électron a une charge négative de -e, l'exact opposé. Ainsi, pour qu'un atome soit neutre, il faut qu'il y ait autant de protons que d'électrons. Le nombre de neutrons n'est pas contraint pour la neutralité ; cependant il est défini afin que le noyau soit le plus stable possible. Les petits noyaux (hélium, carbone, azote) ont autant de neutrons que de protons tandis que les noyaux plus massifs (Uranium) ont un excès de neutrons. Le nom de l'atome est déterminé par son nombre de proton. Ainsi un atome de carbone a 6 protons et un atome de Fluor 9, etc. Deux atomes ayant le même nombre de protons mais un nombre différent de neutrons sont appelés des isotopes, du grec iso (même) et topos (lieu dans le tableau périodique). Seule leur masse totale change. Parmi les isotopes d'un atome, certains sont stables tandis que d'autres subissent des réactions nucléaires de désintégrations qui les transforment en un nouvel atome stable. L'exemple le plus connu est l'isotope 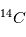 (carbone 14), un noyau de carbone avec 6 protons (donc du carbone), 6 électrons pour être neutre, et 8 neutrons. Cet atome instable se transforme au bout d'un temps caractéristique de 6 000 ans, en
(carbone 14), un noyau de carbone avec 6 protons (donc du carbone), 6 électrons pour être neutre, et 8 neutrons. Cet atome instable se transforme au bout d'un temps caractéristique de 6 000 ans, en 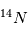 (sept protons et sept neutrons). Une réaction nucléaire change un neutron en un proton en éjectant un électron pour conserver la charge électronique totale. Cet isotope existe encore sur terre même après des milliards d'années d'évolution séculaire car il est régénéré par les rayons cosmiques qui frappent quotidiennement la terre, changeant un atome d'azote en carbone 14. Lorsqu'un corps meurt, il devient un système fermé sans échange avec l'extérieur et alors son rapport entre le
(sept protons et sept neutrons). Une réaction nucléaire change un neutron en un proton en éjectant un électron pour conserver la charge électronique totale. Cet isotope existe encore sur terre même après des milliards d'années d'évolution séculaire car il est régénéré par les rayons cosmiques qui frappent quotidiennement la terre, changeant un atome d'azote en carbone 14. Lorsqu'un corps meurt, il devient un système fermé sans échange avec l'extérieur et alors son rapport entre le 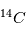 et le
et le 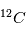 ne cesse de décroître par désintégration. La mesure du rapport permet de déterminer à quelle date l'être vivant est mort. Cela est très utilisé pour déterminer l'âge des momies. Cette méthode ne peut permettre des datations plus anciennes que quelques dizaines de milliers d'années car après cela tout le
ne cesse de décroître par désintégration. La mesure du rapport permet de déterminer à quelle date l'être vivant est mort. Cela est très utilisé pour déterminer l'âge des momies. Cette méthode ne peut permettre des datations plus anciennes que quelques dizaines de milliers d'années car après cela tout le 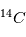 est désintégré.
est désintégré.

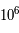 .
.
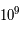 K et était un plasma. On est bien avant l'époque de la recombinaison. La matière se divisait en deux catégories : les protons (87% de la masse) et les neutrons (13% de la masse). Du deutérium et du tritium pouvaient se former mais ils étaient instables du fait des collisions et de l'énergie des photons qui existaient à cette époque.
K et était un plasma. On est bien avant l'époque de la recombinaison. La matière se divisait en deux catégories : les protons (87% de la masse) et les neutrons (13% de la masse). Du deutérium et du tritium pouvaient se former mais ils étaient instables du fait des collisions et de l'énergie des photons qui existaient à cette époque.

 D +
D + , où
, où 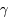 est un photon résultant de la réaction.
est un photon résultant de la réaction.
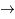 3He +
3He + 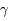 puis 3He + n
puis 3He + n 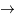 4He +
4He + 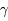
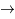 T +
T + 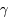 puis T + p
puis T + p 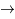 4He +
4He + 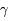
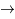
 He + n et D + D
He + n et D + D 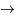 T + p
T + p
 He
He 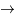
 He +p
He +p
 4He +2p
4He +2p
