 Agencement de la matière chargée électriquement
Agencement de la matière chargée électriquement
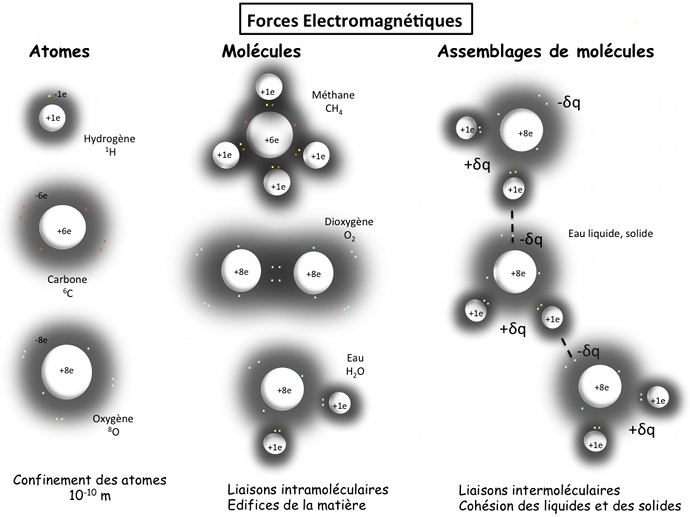
La cohésion, la forme et l'état de la matière (sous forme solide, liquide, gaz) est due à la force électromagnétique qui agence les atomes de manière ordonnée selon des règles bien définies. Ces atomes peuvent s'assembler en molécules, qui peuvent à leur tour s'assembler ; ces édifices de matière chargée électriquement sont tous liés par l'interaction électromagnétique comme nous allons le voir.
Crédit :
ASM/Laurence Tresse
 Ses constituants
Ses constituants
L'atome est constitué de 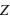 (nombre entier positif) électrons (totalisant une charge électrique négative,
(nombre entier positif) électrons (totalisant une charge électrique négative, 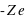 ) orbitant autour d'un noyau (de charge positive,
) orbitant autour d'un noyau (de charge positive, 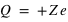 ) avec
) avec 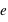 la charge élémentaire valant
la charge élémentaire valant 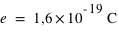 . L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
. L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
L'électron (symbole e-) est une particule élémentaire (on ne peut pas le casser en de plus petites entités de matière), de masse très faible, 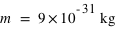 et de charge électrique
et de charge électrique 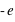 .
.
Dans l'espace aussi restreint de l'atome de 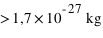 , son noyau atomique (
, son noyau atomique (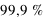 ) concentre l'essentiel (soit
) concentre l'essentiel (soit  ) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).
) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).
 Le classement des atomes
Le classement des atomes
Le tableau périodique des éléments
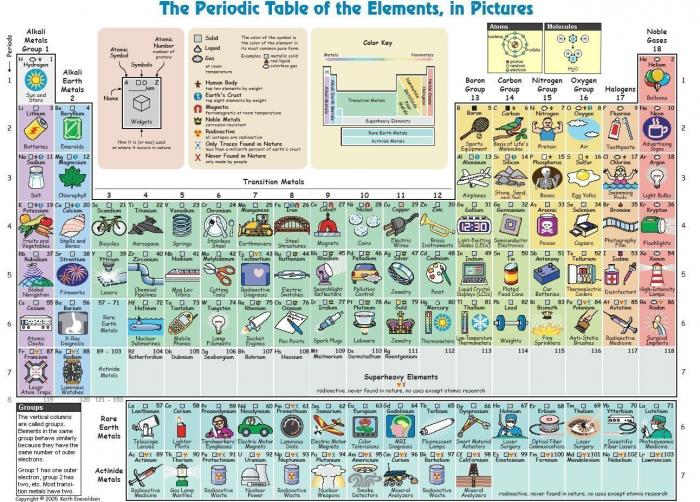
Le numéro atomique Z des atomes croit de gauche à droite, de haut en bas. Il correspond à un élément chimique donné.
Crédit :
Keith Enevoldsen
L'atome est classé selon son numéro atomique Z. Ce numéro correspond à un élément chimique, noté par exemple X ou ZX. L'atome le plus simple (l'hydrogène, 1H) est constitué d'un seul électron (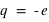 ) et d'un noyau de charge
) et d'un noyau de charge 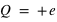 , l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (
, l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (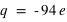 ) et d'un noyau de charge
) et d'un noyau de charge 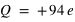 . Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
. Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
L'état naturel des atomes se trouve sous forme soit gazeuse (1H, 2He, 7N, 8O, 9F, 10Ne, 17Cl, 18Ar, 36Kr, 54Xe et 86Ra), soit liquide (35Br, 80Hg) ou soit solide.
 Les composants d'une étoile
Les composants d'une étoile
Difficulté : ☆
Leur composition chimique est décrite par leur quantité (en masse) en hygrogène, en hélium et en éléments plus lourds que ces deux éléments. Cette troisième quantité est nommée métallicité en astronomie, de symbole Z), et elle ne doit pas être confondue avec le numéro atomique (Z). Elle est reliée à l'époque de formation de l'étoile : plus l'époque est jeune, plus la métallicité est faible dans le sens où les éléments lourds dans l'univers jeune n'ont pas encore été synthétisés en grande quantité au sein des étoiles.
Le Soleil est aujourd'hui composé de 73,46 % d'hydrogène et de 24,85 % d'hélium. Sa métallicité 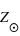 est de 1,69 % avec principalement 0,77 % d'oxygène, 0,29 % de carbone, 0,16 % de fer, 0,12 % d'azote. Il est riche en métaux.
est de 1,69 % avec principalement 0,77 % d'oxygène, 0,29 % de carbone, 0,16 % de fer, 0,12 % d'azote. Il est riche en métaux.
Question 1)
En vous aidant du tableau période des éléments, écrire les éléments chimiques du Soleil sous la forme ZX, X désignant le symbole de l'élément chimique et Z le numéro atomique.
Question 2)
Les étoiles pauvres en métaux (métallicité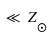 ) sont observées dans le halo de notre Galaxie, soit hors des bras spiraux de notre Galaxie. Que peut-on en déduire sur leur époque de formation ?
) sont observées dans le halo de notre Galaxie, soit hors des bras spiraux de notre Galaxie. Que peut-on en déduire sur leur époque de formation ?
 Les cations et les anions
Les cations et les anions
Lorsque l'on arrache ou ajoute un ou plusieurs électrons à l'atome, le système devient un ion, c'est-à-dire un système électriquement chargé, appelé aussi un cation pour un ion de charge positive, et un anion pour un ion de charge négative. Par exemple, l'ion sodium, 11Na+, est un atome de sodium 11Na ayant perdu un électron (soit 10 électrons orbitants autour d'un noyau de charge 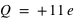 ), l'ion chlorure, 17Cl-, est un atome de chlore 17Cl ayant gagné un électron (soit 18 électrons orbitants autour d'un noyau de charge
), l'ion chlorure, 17Cl-, est un atome de chlore 17Cl ayant gagné un électron (soit 18 électrons orbitants autour d'un noyau de charge 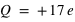 ).
).
 L'eau de mer est fortement ionisée
L'eau de mer est fortement ionisée
L'eau dissout les sels en les décomposant en cations et anions. Par exemple, l'eau de mer contient les ions suivants : le sodium (Na+), le chlorure (Cl-), l'ion magnésium (Mg2+), l'ion calcium (Ca2+), l'ion potassium (K+). Elle contient environ 3,5 % de sels dissous, tandis que l'eau douce en contient moins de 0,05 %.
Question 1)
Donner le numéro atomique et le nombre d'électrons des ions contenus dans l'eau de mer, et dire s'ils sont un cation ou un anion.
Question 2)
Expliquer pourquoi l'ajout de sel dans l'eau douce augmente sa conductivité électrique.
La conductivité électrique est l'aptitude d'un corps matériel à laisser ses charges électriques se déplacer librement.
 L'assemblage des atomes grâce aux forces intramoléculaires
L'assemblage des atomes grâce aux forces intramoléculaires
Les atomes peuvent se lier entre eux en partageant des électrons (en général les plus externes à l'atome), dits des électrons de valence, pour former des molécules. Ces forces intramoléculaires peuvent être covalentes (dans ce cas, elles ont des angles de liaisons bien spécifiques, donc des molécules ayant une forme bien définie), ioniques (entre un métal et non métal, le sel NaCl), ou métallique (entre métaux).
 L'assemblage des molécules grâce aux forces intermoléculaires
L'assemblage des molécules grâce aux forces intermoléculaires
A l'approche de deux atomes (seuls ou dans une molécule), la répartition des charges électriques dans ces systèmes électriquement neutres est perturbée. En modifiant le barycentre des charges électriques positives et négatives, elles créent de faibles dipôles électriques, donc soumis à l'électromagnétisme. Les forces en action, dites forces de van der Waals, permettent les liaisons intermoléculaires, qui sont moins fortes que les liaisons intramoléculaires, mais qui assurent la cohésion des liquides et des solides. Ces forces peuvent être vues comme une force résiduelle de la force électromagnétique qui confine les atomes.
 Les atomes et les molécules sont des systèmes confinés électriquement neutres
Les atomes et les molécules sont des systèmes confinés électriquement neutres
mais, comme nous venons de le voir, c'est toujours la force électromagnétique qui les relient à distance !
 Agencement de la matière chargée électriquement
Agencement de la matière chargée électriquement
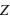 (nombre entier positif) électrons (totalisant une charge électrique négative,
(nombre entier positif) électrons (totalisant une charge électrique négative, 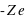 ) orbitant autour d'un noyau (de charge positive,
) orbitant autour d'un noyau (de charge positive, 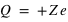 ) avec
) avec 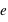 la charge élémentaire valant
la charge élémentaire valant 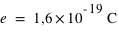 . L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
. L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
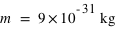 et de charge électrique
et de charge électrique 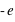 .
.
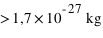 , son noyau atomique (
, son noyau atomique (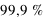 ) concentre l'essentiel (soit
) concentre l'essentiel (soit 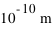 ) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).
) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).

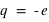 ) et d'un noyau de charge
) et d'un noyau de charge 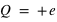 , l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (
, l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (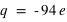 ) et d'un noyau de charge
) et d'un noyau de charge 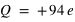 . Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
. Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
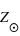 est de 1,69 % avec principalement 0,77 % d'oxygène, 0,29 % de carbone, 0,16 % de fer, 0,12 % d'azote. Il est riche en métaux.
est de 1,69 % avec principalement 0,77 % d'oxygène, 0,29 % de carbone, 0,16 % de fer, 0,12 % d'azote. Il est riche en métaux.
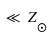 ) sont observées dans le halo de notre Galaxie, soit hors des bras spiraux de notre Galaxie. Que peut-on en déduire sur leur époque de formation ?
) sont observées dans le halo de notre Galaxie, soit hors des bras spiraux de notre Galaxie. Que peut-on en déduire sur leur époque de formation ?
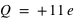 ), l'ion chlorure, 17Cl-, est un atome de chlore 17Cl ayant gagné un électron (soit 18 électrons orbitants autour d'un noyau de charge
), l'ion chlorure, 17Cl-, est un atome de chlore 17Cl ayant gagné un électron (soit 18 électrons orbitants autour d'un noyau de charge 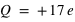 ).
).