L'électron est une particule élémentaire de matière, c'est-à-dire incassable. Lorsqu'il est confiné et orbite dans un atome, il doit respecter des règles...
 La case quantique d'un électron dans l'atome
La case quantique d'un électron dans l'atome
La force électrique dépend de la distance au noyau des électrons. Cette distance n'est pas aléatoire mais quantique : chaque portion de distance (case quantique) représente une certaine région de probabilité radiale dans laquelle un électron peut se mouvoir autour du noyau.
Ces cases quantiques sont stratifiées en une couche électronique (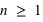 ),
contenant des sous-couches appelées structures fines (
),
contenant des sous-couches appelées structures fines (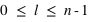 ), et des sous-sous-couches appelées structures hyperfines (
), et des sous-sous-couches appelées structures hyperfines (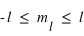 ). Les nombres entiers,
). Les nombres entiers, 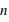 ,
, 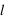 et
et 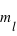 définissent ainsi une case quantique. Nous n'aborderons pas ici la physique qui sous-tend ce comportement quantique.
définissent ainsi une case quantique. Nous n'aborderons pas ici la physique qui sous-tend ce comportement quantique.
 L'état quantique d'un électron dans une case quantique
L'état quantique d'un électron dans une case quantique
La règle à respecter : un électron ne peut pas être dans la même case quantique (c'est-à-dire sur une même orbite atomique, autrement dit ayant les mêmes nombres quantiques 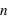 ,
, 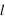 et
et 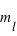 ) qu'un autre électron, sauf si son état quantique décrit par son spin (
) qu'un autre électron, sauf si son état quantique décrit par son spin (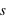 ) est différent.
) est différent.
Le spin d'un électron peut prendre deux valeurs, 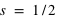 ou
ou 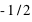 . Donc concrètement cela signifie que deux électrons, au plus, peuvent occuper une orbite atomique donnée.
. Donc concrètement cela signifie que deux électrons, au plus, peuvent occuper une orbite atomique donnée.
 Remarque
Remarque
Une particule élementaire ayant un spin demi-entier fait partie de la famille des fermions.
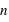 ,
, 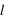 ,
, 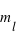 et
et 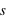 ) dans un système confiné.
) dans un système confiné.
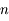 ,
, 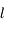 ,
, 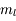 ,
, 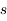 ) sont occupés par un électron. On dit aussi qu'une molécule a une valence nulle, contrairement aux atomes et aux ions.
) sont occupés par un électron. On dit aussi qu'une molécule a une valence nulle, contrairement aux atomes et aux ions.
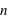 ,
, 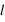 ,
, 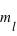 et
et 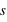 ) dans un atome. L'atome d'hydrogène 1H confine un électron sur une couche électronique (
) dans un atome. L'atome d'hydrogène 1H confine un électron sur une couche électronique (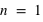 ) autour de son noyau, et l'atome d'oxygène 8O confine huit électrons répartis sur deux couches électroniques (
) autour de son noyau, et l'atome d'oxygène 8O confine huit électrons répartis sur deux couches électroniques (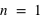 et
et 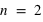 ) autour de son noyau.
) autour de son noyau.
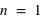 ) de l'atome d'hydrogène ?
) de l'atome d'hydrogène ?
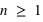 ), (
), (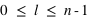 ), (
), (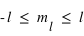 ) et
) et 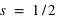 ou
ou 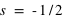 , que les électrons ont tendance à toujours remplir les couches internes (d'abord,
, que les électrons ont tendance à toujours remplir les couches internes (d'abord, 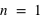 , puis
, puis 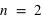 , etc.), et qu'une molécule a tous ses états quantiques remplis.
, etc.), et qu'une molécule a tous ses états quantiques remplis.