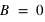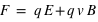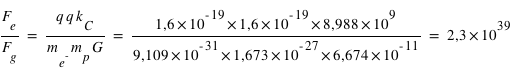Afin que les corps matériels environnants ne soient pas réduits à leurs constituants collés au sol via la pesanteur, une interaction plus forte que la gravitation doit retenir ses constituants dans un espace restreint. De ce fait, la matière pourvue d’une masse peut aussi être dotée d’une charge électrique. Plus les corps matériels sont massifs, plus la gravitation impose des formes sphériques (planètes, étoiles, galaxies). En revanche, la charge électrique permet une cohésion interne des corps moins massifs, et leur donner n'importe quelle forme.
 Caractéristique spécifique de la matière : sa charge électrique
Caractéristique spécifique de la matière : sa charge électrique
Les charges électriques sont liées entre elles via l’interaction électromagnétique. L'unité de base de la charge électrique est le coulomb (C).
Ses effets sont constamment mis à profit dans la vie quotidienne via l’électricité ou la gastronomie, par exemple. Elle permet la cohésion de la matière, elle la structure et la transforme en divers états (solide, liquide, gaz), ses combinaisons multiples font émerger la diversité des corps matériels (vivants ou non) avec des propriétés physiques nombreuses.
 Loi de conservation
Loi de conservation
La charge électrique est conservée dans tout phénomène de transformation de la matière.
 Electricité et magnétisme
Electricité et magnétisme
Pour des charges électriques immobiles, on parle d'interaction électrostatique. Des charges électriques en mouvement créent un courant électrique, lui-même créant un champ magnétique, d'où le terme d'interaction électromagnétique. La matière n'ayant pas de charge électrique ne subit pas ce champ électromagnétique.
Champ électromagnétique
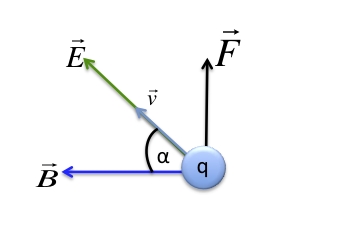
Lorsque des particules ayant une charge électrique (
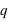
) sont en mouvement (
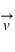
), elles créent un champ magnétique
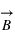
(dit aussi induction magnétique) en sus du champ électrique
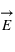
. Ainsi ces particules sont soumises à la force magnétique en sus de la force électrique. Ces deux forces sont couplées sous le terme de force ou interaction électromagnétique
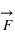
, perpendiculaire au plan formé par les deux champs. Dans un champ électromagnétique, une particule possédant une charge électrique va subir la force, dite de Lorentz :
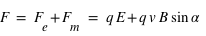
avec
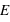
le champ électrique (exprimé en N.C
-1),
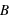
le champ magnétique (exprimé en Tesla),
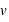
la vitesse des particules, et
α l'angle entre le champ
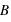
et la direction des particules.
Crédit :
ASM/Laurence Tresse
 Interactions entre l'électron et le proton
Interactions entre l'électron et le proton
Difficulté : ☆
L'électron est une particule de matière chargée en masse, 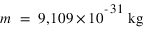 , et chargée en électricité,
, et chargée en électricité, 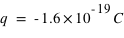 . Le proton est une particule de matière avec
. Le proton est une particule de matière avec 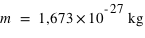 et ayant la même quantité de charge électrique que l'électron mais positive
et ayant la même quantité de charge électrique que l'électron mais positive 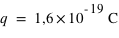 .
.
Question 1)
Calculer le rapport en masse entre le proton et l'électron.
Question 2)
Calculer le rapport de la force électrique sur la force gravitationnelle entre ces deux particules.
La constante de gravitation vaut 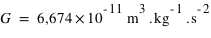 , la constante de Coulomb vaut
, la constante de Coulomb vaut 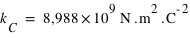 .
.
Question 3)
A de faibles distances de séparation, en l'absence de toutes autres forces extérieures, en déduisez-vous que l'électron va tomber sur le proton ? Pourquoi ?
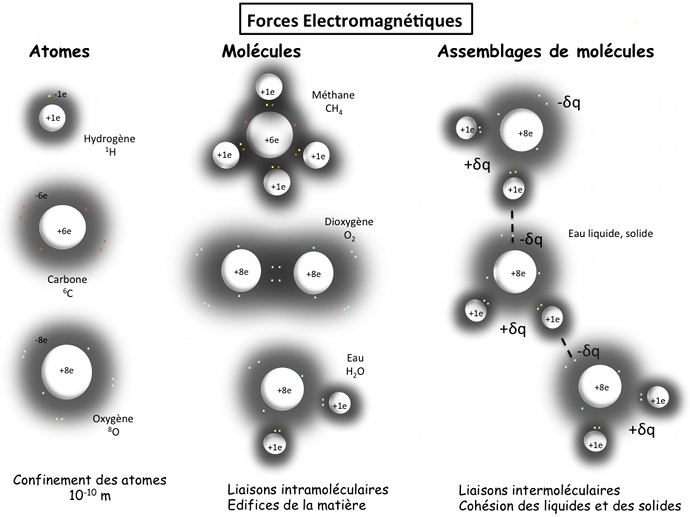
 Agencement de la matière chargée électriquement
Agencement de la matière chargée électriquement
La cohésion, la forme et l'état de la matière (sous forme solide, liquide, gaz) est due à la force électromagnétique qui agence les atomes de manière ordonnée selon des règles bien définies. Ces atomes peuvent s'assembler en molécules, qui peuvent à leur tour s'assembler ; ces édifices de matière chargée électriquement sont tous liés par l'interaction électromagnétique comme nous allons le voir.
Crédit :
ASM/Laurence Tresse
 Ses constituants
Ses constituants
L'atome est constitué de 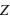 (nombre entier positif) électrons (totalisant une charge électrique négative,
(nombre entier positif) électrons (totalisant une charge électrique négative, 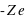 ) orbitant autour d'un noyau (de charge positive,
) orbitant autour d'un noyau (de charge positive, 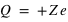 ) avec
) avec 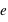 la charge élémentaire valant
la charge élémentaire valant 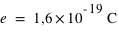 . L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
. L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
L'électron (symbole e-) est une particule élémentaire (on ne peut pas le casser en de plus petites entités de matière), de masse très faible, 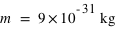 et de charge électrique
et de charge électrique 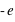 .
.
Dans l'espace aussi restreint de l'atome de 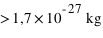 , son noyau atomique (
, son noyau atomique (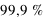 ) concentre l'essentiel (soit
) concentre l'essentiel (soit 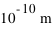 ) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).
) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).
 Le classement des atomes
Le classement des atomes
Le tableau périodique des éléments
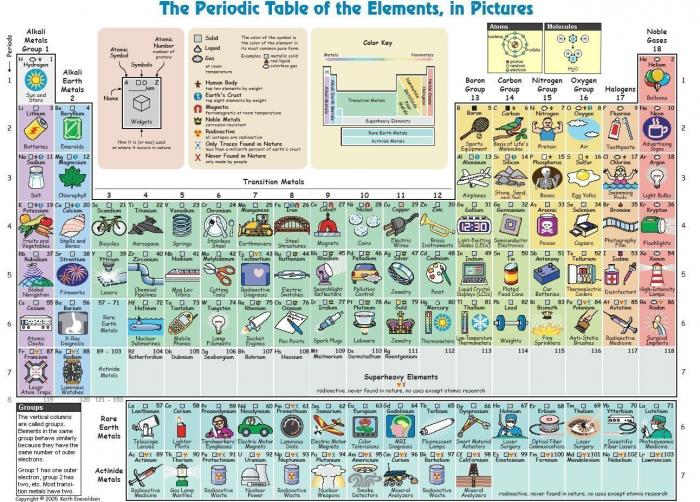
Le numéro atomique Z des atomes croit de gauche à droite, de haut en bas. Il correspond à un élément chimique donné.
Crédit :
Keith Enevoldsen
L'atome est classé selon son numéro atomique Z. Ce numéro correspond à un élément chimique, noté par exemple X ou ZX. L'atome le plus simple (l'hydrogène, 1H) est constitué d'un seul électron (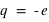 ) et d'un noyau de charge
) et d'un noyau de charge 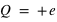 , l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (
, l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (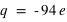 ) et d'un noyau de charge
) et d'un noyau de charge 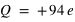 . Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
. Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
L'état naturel des atomes se trouve sous forme soit gazeuse (1H, 2He, 7N, 8O, 9F, 10Ne, 17Cl, 18Ar, 36Kr, 54Xe et 86Ra), soit liquide (35Br, 80Hg) ou soit solide.
 Les composants d'une étoile
Les composants d'une étoile
Difficulté : ☆
Leur composition chimique est décrite par leur quantité (en masse) en hygrogène, en hélium et en éléments plus lourds que ces deux éléments. Cette troisième quantité est nommée métallicité en astronomie, de symbole Z), et elle ne doit pas être confondue avec le numéro atomique (Z). Elle est reliée à l'époque de formation de l'étoile : plus l'époque est jeune, plus la métallicité est faible dans le sens où les éléments lourds dans l'univers jeune n'ont pas encore été synthétisés en grande quantité au sein des étoiles.
Le Soleil est aujourd'hui composé de 73,46 % d'hydrogène et de 24,85 % d'hélium. Sa métallicité 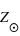 est de 1,69 % avec principalement 0,77 % d'oxygène, 0,29 % de carbone, 0,16 % de fer, 0,12 % d'azote. Il est riche en métaux.
est de 1,69 % avec principalement 0,77 % d'oxygène, 0,29 % de carbone, 0,16 % de fer, 0,12 % d'azote. Il est riche en métaux.
Question 1)
En vous aidant du tableau période des éléments, écrire les éléments chimiques du Soleil sous la forme ZX, X désignant le symbole de l'élément chimique et Z le numéro atomique.
Question 2)
Les étoiles pauvres en métaux (métallicité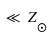 ) sont observées dans le halo de notre Galaxie, soit hors des bras spiraux de notre Galaxie. Que peut-on en déduire sur leur époque de formation ?
) sont observées dans le halo de notre Galaxie, soit hors des bras spiraux de notre Galaxie. Que peut-on en déduire sur leur époque de formation ?
 Les cations et les anions
Les cations et les anions
Lorsque l'on arrache ou ajoute un ou plusieurs électrons à l'atome, le système devient un ion, c'est-à-dire un système électriquement chargé, appelé aussi un cation pour un ion de charge positive, et un anion pour un ion de charge négative. Par exemple, l'ion sodium, 11Na+, est un atome de sodium 11Na ayant perdu un électron (soit 10 électrons orbitants autour d'un noyau de charge 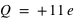 ), l'ion chlorure, 17Cl-, est un atome de chlore 17Cl ayant gagné un électron (soit 18 électrons orbitants autour d'un noyau de charge
), l'ion chlorure, 17Cl-, est un atome de chlore 17Cl ayant gagné un électron (soit 18 électrons orbitants autour d'un noyau de charge 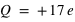 ).
).
 L'eau de mer est fortement ionisée
L'eau de mer est fortement ionisée
L'eau dissout les sels en les décomposant en cations et anions. Par exemple, l'eau de mer contient les ions suivants : le sodium (Na+), le chlorure (Cl-), l'ion magnésium (Mg2+), l'ion calcium (Ca2+), l'ion potassium (K+). Elle contient environ 3,5 % de sels dissous, tandis que l'eau douce en contient moins de 0,05 %.
Question 1)
Donner le numéro atomique et le nombre d'électrons des ions contenus dans l'eau de mer, et dire s'ils sont un cation ou un anion.
Question 2)
Expliquer pourquoi l'ajout de sel dans l'eau douce augmente sa conductivité électrique.
La conductivité électrique est l'aptitude d'un corps matériel à laisser ses charges électriques se déplacer librement.
 L'assemblage des atomes grâce aux forces intramoléculaires
L'assemblage des atomes grâce aux forces intramoléculaires
Les atomes peuvent se lier entre eux en partageant des électrons (en général les plus externes à l'atome), dits des électrons de valence, pour former des molécules. Ces forces intramoléculaires peuvent être covalentes (dans ce cas, elles ont des angles de liaisons bien spécifiques, donc des molécules ayant une forme bien définie), ioniques (entre un métal et non métal, le sel NaCl), ou métallique (entre métaux).
 L'assemblage des molécules grâce aux forces intermoléculaires
L'assemblage des molécules grâce aux forces intermoléculaires
A l'approche de deux atomes (seuls ou dans une molécule), la répartition des charges électriques dans ces systèmes électriquement neutres est perturbée. En modifiant le barycentre des charges électriques positives et négatives, elles créent de faibles dipôles électriques, donc soumis à l'électromagnétisme. Les forces en action, dites forces de van der Waals, permettent les liaisons intermoléculaires, qui sont moins fortes que les liaisons intramoléculaires, mais qui assurent la cohésion des liquides et des solides. Ces forces peuvent être vues comme une force résiduelle de la force électromagnétique qui confine les atomes.
 Les atomes et les molécules sont des systèmes confinés électriquement neutres
Les atomes et les molécules sont des systèmes confinés électriquement neutres
mais, comme nous venons de le voir, c'est toujours la force électromagnétique qui les relient à distance !
L'électron est une particule élémentaire de matière, c'est-à-dire incassable. Lorsqu'il est confiné et orbite dans un atome, il doit respecter des règles...
 Remarque
Remarque
Une particule élementaire ayant un spin demi-entier fait partie de la famille des fermions.
 Les états quantiques de l'hydrogène et de l'oxygène
Les états quantiques de l'hydrogène et de l'oxygène
Difficulté : ☆☆
Le principe de Pauli interdit aux électrons d'avoir les mêmes nombres quantiques (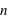 ,
, 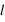 ,
, 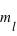 et
et 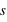 ) dans un atome. L'atome d'hydrogène 1H confine un électron sur une couche électronique (
) dans un atome. L'atome d'hydrogène 1H confine un électron sur une couche électronique (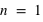 ) autour de son noyau, et l'atome d'oxygène 8O confine huit électrons répartis sur deux couches électroniques (
) autour de son noyau, et l'atome d'oxygène 8O confine huit électrons répartis sur deux couches électroniques (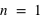 et
et 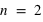 ) autour de son noyau.
) autour de son noyau.
Question 1)
Un électron peut-il être ajouté sur la couche électronique (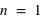 ) de l'atome d'hydrogène ?
) de l'atome d'hydrogène ?
Question 2)
Combien d'électrons peuvent-ils être ajoutés à l'atome d'oxygène ? Quels ions en découlent-il ?
Question 3)
Plutôt que de leur ajouter des électrons, ces atomes peuvent partager des électrons (électrons de valence) tout en respectant le principe de Pauli. Quelles molécules peuvent-elles être crées avec deux atomes H et deux atomes O ?
- Question 1
Aide :
On se souviendra que (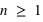 ), (
), (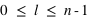 ), (
), (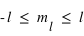 ) et
) et 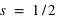 ou
ou 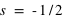 , que les électrons ont tendance à toujours remplir les couches internes (d'abord,
, que les électrons ont tendance à toujours remplir les couches internes (d'abord, 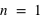 , puis
, puis 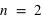 , etc.), et qu'une molécule a tous ses états quantiques remplis.
, etc.), et qu'une molécule a tous ses états quantiques remplis.
Solution :
Oui, d'après le Principe de Pauli, deux électrons peuvent appartenir à une même couche électronique (ou orbite atomique) s'ils ont un spin différent. Pour n=1, on a comme états quantiques possibles : l=0, ml=0, s=1/2 et l=0, ml=0, s=-1/2. L'atome devient l'ion (ou anion) 1H-.
- Question 2
Solution :
La première couche contient deux électrons de spin différent, chacun ayant un état quantique différent (n=1, l=0, ml=0, s=1/2 et -1/2). La deuxième couche contient les états quantiques suivants (n=2, l=0, ml=0, s=1/2 et -1/2) et (n=2, l=1, ml=-1, s=1/2 et -1/2), (n=2, l=1, ml=0, s=1/2 et -1/2) et (n=2, l=1, ml=1, s=1/2 et -1/2), soit 4 cases quantiques pour 8 états quantiques. L'atome d'oxygène est un système à 10 états quantiques pour 8 électrons, donc deux états restent libres pour y ajouter un ou deux électrons. L'atome devient alors l'ion 8O- (ion peroxyde) ou 8O2- (ion oxyde).
- Question 3
Solution :
Une molécule a une valence nulle. Nous avons vu que l'hydrogène n'a qu'un état quantique de libre à partager, et l'oxygène deux. On peut donc former les molécules de dihydrogène H2 (H-H, 1 électron de valence pour chaque H), de dioxygène O2 (O=O, 2 électrons de valence pour chaque O), d'eau H2O (H-O-H, 1 électron de valence pour chaque H et 2 électrons de valence pour O), de peroxyde d'hydrogène H2O2 (H-O-O-H, 1 électron de valence pour chaque H et 2 électrons de valence pour chaque O). L'assemblage OH n'est pas une molécule, mais un radical (hydroxyde) car il reste un état quantique de libre (une valence). Le radical -OH est présent dans les molécules d'alcool (méthanol, ethanol, butanol, etc.)
 Caractéristique spécifique de la matière : sa charge électrique
Caractéristique spécifique de la matière : sa charge électrique Loi de conservation
Loi de conservation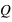 (positive ou négative), crée un champ électrique autour de lui dans une sphère de rayon
(positive ou négative), crée un champ électrique autour de lui dans une sphère de rayon 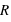 ,
, 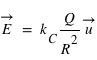 .
. 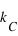 est la constante de Coulomb égale à
est la constante de Coulomb égale à 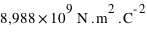 et
et 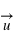 le vecteur unitaire partant de la charge
le vecteur unitaire partant de la charge 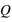 . Dans ce champ, un autre corps de matière chargée électriquement va subir ce champ électrique attractif ou répulsif. La force d’interaction subie par une charge électrique
. Dans ce champ, un autre corps de matière chargée électriquement va subir ce champ électrique attractif ou répulsif. La force d’interaction subie par une charge électrique 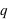 située à une distance
située à une distance 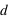 de la charge électrique
de la charge électrique 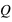 vaut :
vaut : 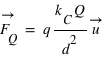 .
.
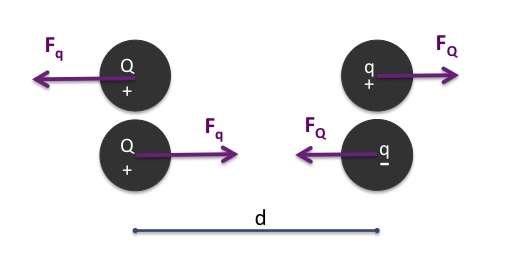
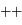 ou
ou 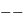 , et attractive entre charges
, et attractive entre charges 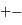 , et leurs valeurs sont égales,
, et leurs valeurs sont égales, 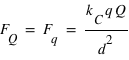 .
.

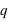 ) sont en mouvement (
) sont en mouvement (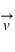 ), elles créent un champ magnétique
), elles créent un champ magnétique 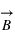 (dit aussi induction magnétique) en sus du champ électrique
(dit aussi induction magnétique) en sus du champ électrique 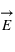 . Ainsi ces particules sont soumises à la force magnétique en sus de la force électrique. Ces deux forces sont couplées sous le terme de force ou interaction électromagnétique
. Ainsi ces particules sont soumises à la force magnétique en sus de la force électrique. Ces deux forces sont couplées sous le terme de force ou interaction électromagnétique 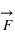 , perpendiculaire au plan formé par les deux champs. Dans un champ électromagnétique, une particule possédant une charge électrique va subir la force, dite de Lorentz :
, perpendiculaire au plan formé par les deux champs. Dans un champ électromagnétique, une particule possédant une charge électrique va subir la force, dite de Lorentz : 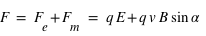 avec
avec 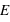 le champ électrique (exprimé en N.C-1),
le champ électrique (exprimé en N.C-1), 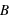 le champ magnétique (exprimé en Tesla),
le champ magnétique (exprimé en Tesla), 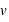 la vitesse des particules, et
la vitesse des particules, et 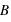 et la direction des particules.
et la direction des particules.
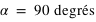 , quelle est l'expression de la force électromagnétique ?
, quelle est l'expression de la force électromagnétique ?
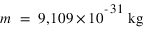 , et chargée en électricité,
, et chargée en électricité, 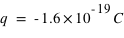 . Le proton est une particule de matière avec
. Le proton est une particule de matière avec 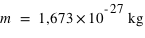 et ayant la même quantité de charge électrique que l'électron mais positive
et ayant la même quantité de charge électrique que l'électron mais positive 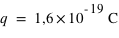 .
.
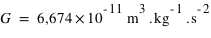 , la constante de Coulomb vaut
, la constante de Coulomb vaut 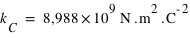 .
.

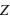 (nombre entier positif) électrons (totalisant une charge électrique négative,
(nombre entier positif) électrons (totalisant une charge électrique négative, 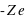 ) orbitant autour d'un noyau (de charge positive,
) orbitant autour d'un noyau (de charge positive, 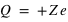 ) avec
) avec 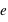 la charge élémentaire valant
la charge élémentaire valant 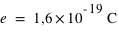 . L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
. L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
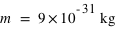 et de charge électrique
et de charge électrique 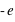 .
.
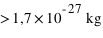 , son noyau atomique (
, son noyau atomique (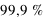 ) concentre l'essentiel (soit
) concentre l'essentiel (soit 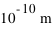 ) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).
) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).

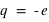 ) et d'un noyau de charge
) et d'un noyau de charge 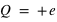 , l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (
, l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (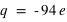 ) et d'un noyau de charge
) et d'un noyau de charge 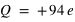 . Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
. Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
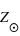 est de 1,69 % avec principalement 0,77 % d'oxygène, 0,29 % de carbone, 0,16 % de fer, 0,12 % d'azote. Il est riche en métaux.
est de 1,69 % avec principalement 0,77 % d'oxygène, 0,29 % de carbone, 0,16 % de fer, 0,12 % d'azote. Il est riche en métaux.
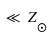 ) sont observées dans le halo de notre Galaxie, soit hors des bras spiraux de notre Galaxie. Que peut-on en déduire sur leur époque de formation ?
) sont observées dans le halo de notre Galaxie, soit hors des bras spiraux de notre Galaxie. Que peut-on en déduire sur leur époque de formation ?
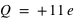 ), l'ion chlorure, 17Cl-, est un atome de chlore 17Cl ayant gagné un électron (soit 18 électrons orbitants autour d'un noyau de charge
), l'ion chlorure, 17Cl-, est un atome de chlore 17Cl ayant gagné un électron (soit 18 électrons orbitants autour d'un noyau de charge 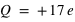 ).
).
 ),
contenant des sous-couches appelées structures fines (
),
contenant des sous-couches appelées structures fines ( ), et des sous-sous-couches appelées structures hyperfines (
), et des sous-sous-couches appelées structures hyperfines (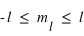 ). Les nombres entiers,
). Les nombres entiers, 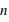 ,
, 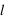 et
et 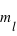 définissent ainsi une case quantique. Nous n'aborderons pas ici la physique qui sous-tend ce comportement quantique.
définissent ainsi une case quantique. Nous n'aborderons pas ici la physique qui sous-tend ce comportement quantique.
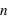 ,
, 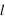 et
et 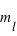 ) qu'un autre électron, sauf si son état quantique décrit par son spin (
) qu'un autre électron, sauf si son état quantique décrit par son spin (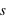 ) est différent.
) est différent.
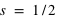 ou
ou 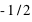 . Donc concrètement cela signifie que deux électrons, au plus, peuvent occuper une orbite atomique donnée.
. Donc concrètement cela signifie que deux électrons, au plus, peuvent occuper une orbite atomique donnée.
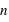 ,
, 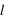 ,
, 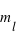 et
et 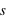 ) dans un système confiné.
) dans un système confiné.
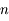 ,
, 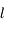 ,
, 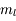 ,
, 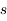 ) sont occupés par un électron. On dit aussi qu'une molécule a une valence nulle, contrairement aux atomes et aux ions.
) sont occupés par un électron. On dit aussi qu'une molécule a une valence nulle, contrairement aux atomes et aux ions.
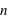 ,
,  ,
, 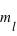 et
et 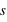 ) dans un atome. L'atome d'hydrogène 1H confine un électron sur une couche électronique (
) dans un atome. L'atome d'hydrogène 1H confine un électron sur une couche électronique (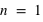 ) autour de son noyau, et l'atome d'oxygène 8O confine huit électrons répartis sur deux couches électroniques (
) autour de son noyau, et l'atome d'oxygène 8O confine huit électrons répartis sur deux couches électroniques (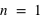 et
et 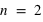 ) autour de son noyau.
) autour de son noyau.
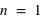 ) de l'atome d'hydrogène ?
) de l'atome d'hydrogène ?
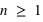 ), (
), (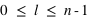 ), (
), (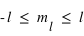 ) et
) et 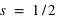 ou
ou 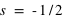 , que les électrons ont tendance à toujours remplir les couches internes (d'abord,
, que les électrons ont tendance à toujours remplir les couches internes (d'abord, 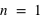 , puis
, puis 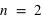 , etc.), et qu'une molécule a tous ses états quantiques remplis.
, etc.), et qu'une molécule a tous ses états quantiques remplis.
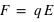 et
et