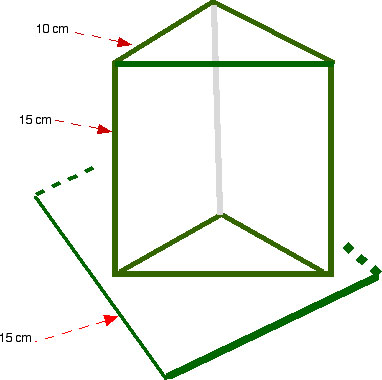
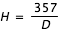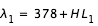Réaliser un prisme creux par collage de trois plaques de verre de 4 mm d'épaisseur et de dimension 10 x 15 cm environ, posées sur une quatrième plaque de 15 x 15 cm ; l'ensemble étant collé avec du mastic-joint à base de silicone (voir figure ci-dessous).
Cette expérience permet de conduire l'élève à découvrir que la lumière blanche du soleil est composée de lumières colorées (7 en théorie ou 6 selon que l'on peut ou non voir la différence entre l'indigo et le violet). Orienter le prisme rempli d'eau de manière à obtenir sur l'écran toutes les couleurs : violet, indigo, bleu, vert, jaune, orangé, rouge.
Un système dispersif : le prisme
Crédit :
ASM
Cette expérience illustre le principe de la formation d'un arc-en-ciel. Un miroir est plongé dans une cuvette remplie d'eau posée sous une source lumineuse. L'écran est placé devant le miroir. Il faut chercher l'inclinaison du miroir et la position de l'écran de manière à faire appraître un "arc-en-ciel". Chaque élève dessine dans son cahier l'expérience telle qu'il se la représente.
Observations et manipulations
Les élèves peuvent de nouveau observer les couleurs de l'arc-en-ciel, vérifier leur nombre et leur ordre.
Ils remarquent qu'il faut orienter correctement le miroir face au Soleil pour obtenir correctement le spectre des couleurs et qu'en faisant varier l'inclinaison du miroir, l'arc-en-ciel peut être projeté sur le mur, le bord de la cuvette ou disparaître.
Ils observent que l'intensité des couleurs se modifie en fonction de la luminosité extérieure. Ainsi, ils remarquent que les couleurs du
spectre pâlissent puis disparaissent lorsqu'un nuage s'approche du Soleil et
le masque complètement. De la même façon pour l'opération inverse : plus le nuage s'éloigne plus les couleurs deviennent vives.
Enfin, ils remarquent que c'est la partie immergée du miroir qui projette
l'arc-en-ciel : en effet, en cachant avec un carton la partie du miroir qui
est hors de l'eau, ils s'aperçoivent que l'arc-en-ciel est toujours présent. Ils s'aperçoivent qu'en faisant bouger la surface de l'eau, les couleurs de l'arc-en-ciel se mélangent et bougent comme des vagues.
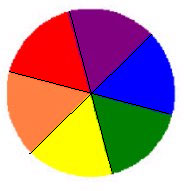
Cette expérience consiste à suivre la démarche inverse que celle de la dispersion de la lumière suivie dans les expériences I et II : la superposition de toutes les couleurs du spectre solaire reproduit la lumière blanche.
Sur un disque de 20 cm de diamètre, tracer 6 secteurs identiques. Dans les feuilles de couleur, découper un secteur de chaque couleur. Coller ces morceaux sur le disque, comme les couleurs de l'arc-en-ciel. Planter un crayon au centre du disque, puis faites-le tourner très vite comme une toupie : un blanc laiteux apparaît (voir figure ci-dessous)
Disque de couleurs
Crédit :
ASM
Spectre étudié
La figure ci-dessous représente le spectre solaire allant de 378 à 735 nm (nm = nanomètre). Ce spectre contient plusieurs raies d'absorption (numérotées de 1 à 8 de gauche à droite) : ce sont des raies de Fraunhofer dues à l'absorption des rayonnements par les éléments présents dans les couches extérieures de l'atmosphère du Soleil.
Le spectre du soleil allant de 378 à 735 nm

Crédit :
ASM, Delbouille et al
L'étude des raies de ce spectre permet donc d'identifier des éléments présents dans le Soleil.
Méthode d'identification
On se propose de mesurer les positions de 9 raies d'absorption du spectre solaire et de déterminer les longueurs d'onde afin de pouvoir identifier certains éléments chimiques présents dans le Soleil. Pour cela :
- 1. imprimer le spectre et mesurer la longueur du spectre D en millimètre (mm) qui correspondra à l'étendue du spectre en nanomètre : 735-378 = 357 nm. L'échelle du document, en nanomètre par millimètre, est donc :
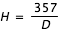
- 2. mesurer la longueur L1 (mm) correspondant à la raie d'absorption numéro 1. La longueur d'onde, en nanomètre, de la raie d'absorption numéro 1 est alors donnée par :
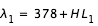
- 3. faire de même pour les raies 2, .., 9.
- 4. identifier les éléments chimiques dont ces 9 raies sont caractéristiques (voir ci-dessous les longueurs d'onde des raies caractéristiques d'un ensemble d'éléments chimiques). En déduire quelques éléments chimiques présents dans l'atmosphère solaire.
| Elément chimique |
Longueur d'onde en nm |
| H I (hydrogène neutre) |
388.9, 397.0, 410.2, 434.0, 486.1, 656.3 |
| Na I (Sodium neutre) |
589.0, 589.6 |
| Mg I (Magnésium neutre) |
309.7, 470.3, 516.7, 517.3, 518.4 |
| Ca I (Calcium neutre) |
422.7, 458.2, 526.2, 527.0, 616.2, 616.9, 650.0 |
| Ca II (Calcium une fois ionisé) |
393.4, 396.8 |
| Cr I (Crome neutre) |
435.2, 461.3, 464.6 |
| V I (Vanadium neutre) |
770.3 |
| V II (Vanadium une fois ionisé) |
316.8, 399.7 |
| F I (Fluor neutre) |
821.5 |
| Ti I (Titane neutre) |
466.8, 469.1, 498.2 |
| Fe I (Fer neutre) |
389.9, 404.6, 423.4, 425.1, 426.0, 427.2, 438.3, 452.9, 459.3,
489.1, 491.9, 495.7, 501.2, 508.0, 527.0, 532.8, 536.7, 536.9, 543.0,
543.4, 544.7, 545.6, 561.6, 822.0 |
| Ba I (Baryum neutre) |
318.4 |
| Mn I (Manganèse neutre) |
403.6, 403.1, 402.1 |
| Ni I (Nickel neutre) |
508.0, 508.5 |
| O IV (Oxygène trois fois ionisé) |
480.05 |
| Eu I (Europium neutre) |
535.2 |
| Sc I (Scandium neutre) |
769.5 |
| O2 (Molécule de dioxygène présente dans l'atmosphère terrestre) |
686.7 |
| CH (molécule de méthylidyne) |
430.5 |
Longueurs d'onde en nanomètre (nm) des raies caractéristiques des éléments chimiques fréquemment rencontrés.
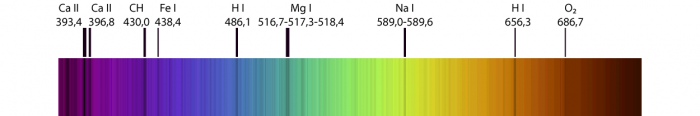
Cette figure donne le nom ainsi que la longueur d'onde (en nanomètre) des éléments identifiés :
Éléments chimiques identifiés
Crédit :
ASM
Les raies identifiées sont celles de l'ion Ca+ excité (notation spectroscopique Ca II), des atomes excités de fer (Fe I), d'hydrogène (H I), de magnésium (Mg I), de sodium (Na I) et de la molécule CH. Ces éléments sont présents dans les couches de l'atmosphère solaire au dessus de la photosphère. Par contre, la molécule O2 détectée est présente dans l'atmosphère de la Terre.
Tous ces éléments ont absorbé, dans des longueurs d'onde qui les caractérisent, une partie de la lumière émise au niveau de la photosphère au cours de son parcours jusqu'au spectromètre sur Terre qui a mesuré ce spectre.
La spectroscopie est donc un puissant moyen d'investigation qui nous a permis d'identifier des éléments chimiques dans l'atmosphère solaire.