Objetivos
Objetivos
El hidrógeno, el constituyente mayoritario, presenta firmas espectrales bien definidas.
El caso del hidrógeno
El átomo mas simple es el hidrógeno, es también el que posee el espectro mas simple. A seguir se describe el espectro de este elemento, el más abundante en el Universo.
Las series de Balmer, Paschen ...
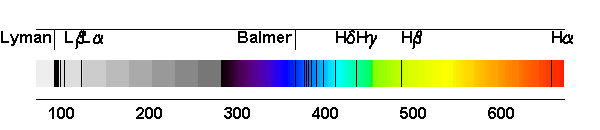
Las primeras líneas espectrales del hidrógeno a ser estudiadas están situadas en el dominio visible del espectro, aunque tienden a aproximarse las unas de las otras hacia un limite situado en el próximo ultavioleta. Esta serie de líneas se llama la
serie de Balmer. Las primeras líneas son denotadas con el alfabeto griego. La primera línea, Hα tiene una longitud de onda de 656,2 nm, es por lo tanto roja. La segunda Hβ es azul con λ=486,1 nm, la tercera, Hγ, es violeta con λ=434,0 nm,y así sucesivamente hasta 364,6 nm. Esta última es la longitude de onda limite de la serie de Balmer.
Cuando el nivel inferior es el nivel fundamental,
la serie de líneas se llama serie de Lyman. Esta serie de líneas se sitúa en el ultravioleta. La serie correspondiente a un nivel de inferior igual a n=2 se sitúa en el visible y se llama serie de Balmer. La serie correspondiente a un nivel de inferieur igual a n=3 se sitúa en el infrarrojo y se llama serie de Paschen.
Líneas del l'hidrógeno
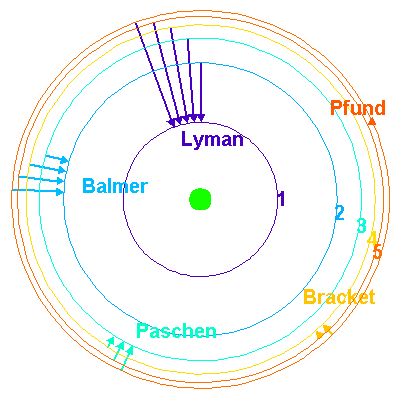
Familias espectrales del hidrógeno, definidas por el nivel de energía inferior
Crédito : Astrophysique sur Mesure