Les atomes |
L'atome est constitué de 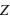 (nombre entier positif) électrons (totalisant une charge électrique négative,
(nombre entier positif) électrons (totalisant une charge électrique négative, 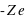 ) orbitant autour d'un noyau (de charge positive,
) orbitant autour d'un noyau (de charge positive, 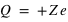 ) avec
) avec 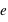 la charge élémentaire valant
la charge élémentaire valant 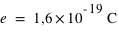 . L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
. L'atome est électriquement neutre. Il peut contenir plus d'une centaine d'électrons.
L'électron (symbole e-) est une particule élémentaire (on ne peut pas le casser en de plus petites entités de matière), de masse très faible, 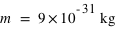 et de charge électrique
et de charge électrique 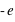 .
.
Dans l'espace aussi restreint de l'atome de 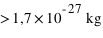 , son noyau atomique (
, son noyau atomique (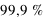 ) concentre l'essentiel (soit
) concentre l'essentiel (soit 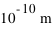 ) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).
) de la masse atomique. Les électrons, bien plus légers en masse, ne tombent cependant pas sur le noyau (plus de part la force électromagnétique ici attractive que de part la force de gravitation, voir l'exercice précédent). En effet, leur mouvement autour du noyau est régi par la physique quantique, et non pas par la physique classique où une planète en mouvement orbital ne tombe pas sur son étoile. La physique quantique introduit la notion de probabilité dans les phénomènes physiques ; non seulement la probabilité qu'un électron rentre spontanément dans le noyau est nulle pour la majorité des noyaux (excepté dans le cas de la capture électronique abordé plus loin), mais aussi la probabilité d'être sur une certaine orbite doit respecter le Principe de Pauli (voir plus loin).
L'atome est classé selon son numéro atomique Z. Ce numéro correspond à un élément chimique, noté par exemple X ou ZX. L'atome le plus simple (l'hydrogène, 1H) est constitué d'un seul électron (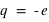 ) et d'un noyau de charge
) et d'un noyau de charge 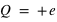 , l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (
, l'atome le plus dense, existant à l'état naturel (le plutonium, 94Pu) est constitué de 94 électrons (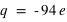 ) et d'un noyau de charge
) et d'un noyau de charge 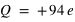 . Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
. Les éléments chimiques sont regroupés selon dans "le tableau périodique des éléments" (dit aussi tableau de Mendeleïev).
L'état naturel des atomes se trouve sous forme soit gazeuse (1H, 2He, 7N, 8O, 9F, 10Ne, 17Cl, 18Ar, 36Kr, 54Xe et 86Ra), soit liquide (35Br, 80Hg) ou soit solide.