
Isotopes et ions |
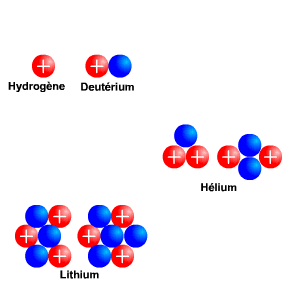
Les neutrons, comme leur nom l'indique, sont électriquement neutres. Les protons ont eux une charge positive +e (+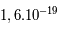 Coulomb) alors que l'électron a une charge négative de -e, l'exact opposé. Ainsi, pour qu'un atome soit neutre, il faut qu'il y ait autant de protons que d'électrons. Le nombre de neutrons n'est pas contraint pour la neutralité ; cependant il est défini afin que le noyau soit le plus stable possible. Les petits noyaux (hélium, carbone, azote) ont autant de neutrons que de protons tandis que les noyaux plus massifs (Uranium) ont un excès de neutrons. Le nom de l'atome est déterminé par son nombre de proton. Ainsi un atome de carbone a 6 protons et un atome de Fluor 9, etc. Deux atomes ayant le même nombre de protons mais un nombre différent de neutrons sont appelés des isotopes, du grec iso (même) et topos (lieu dans le tableau périodique). Seule leur masse totale change. Parmi les isotopes d'un atome, certains sont stables tandis que d'autres subissent des réactions nucléaires de désintégrations qui les transforment en un nouvel atome stable. L'exemple le plus connu est l'isotope
Coulomb) alors que l'électron a une charge négative de -e, l'exact opposé. Ainsi, pour qu'un atome soit neutre, il faut qu'il y ait autant de protons que d'électrons. Le nombre de neutrons n'est pas contraint pour la neutralité ; cependant il est défini afin que le noyau soit le plus stable possible. Les petits noyaux (hélium, carbone, azote) ont autant de neutrons que de protons tandis que les noyaux plus massifs (Uranium) ont un excès de neutrons. Le nom de l'atome est déterminé par son nombre de proton. Ainsi un atome de carbone a 6 protons et un atome de Fluor 9, etc. Deux atomes ayant le même nombre de protons mais un nombre différent de neutrons sont appelés des isotopes, du grec iso (même) et topos (lieu dans le tableau périodique). Seule leur masse totale change. Parmi les isotopes d'un atome, certains sont stables tandis que d'autres subissent des réactions nucléaires de désintégrations qui les transforment en un nouvel atome stable. L'exemple le plus connu est l'isotope 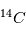 (carbone 14), un noyau de carbone avec 6 protons (donc du carbone), 6 électrons pour être neutre, et 8 neutrons. Cet atome instable se transforme au bout d'un temps caractéristique de 6 000 ans, en
(carbone 14), un noyau de carbone avec 6 protons (donc du carbone), 6 électrons pour être neutre, et 8 neutrons. Cet atome instable se transforme au bout d'un temps caractéristique de 6 000 ans, en 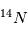 (sept protons et sept neutrons). Une réaction nucléaire change un neutron en un proton en éjectant un électron pour conserver la charge électronique totale. Cet isotope existe encore sur terre même après des milliards d'années d'évolution séculaire car il est régénéré par les rayons cosmiques qui frappent quotidiennement la terre, changeant un atome d'azote en carbone 14. Lorsqu'un corps meurt, il devient un système fermé sans échange avec l'extérieur et alors son rapport entre le
(sept protons et sept neutrons). Une réaction nucléaire change un neutron en un proton en éjectant un électron pour conserver la charge électronique totale. Cet isotope existe encore sur terre même après des milliards d'années d'évolution séculaire car il est régénéré par les rayons cosmiques qui frappent quotidiennement la terre, changeant un atome d'azote en carbone 14. Lorsqu'un corps meurt, il devient un système fermé sans échange avec l'extérieur et alors son rapport entre le 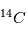 et le
et le 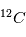 ne cesse de décroître par désintégration. La mesure du rapport permet de déterminer à quelle date l'être vivant est mort. Cela est très utilisé pour déterminer l'âge des momies. Cette méthode ne peut permettre des datations plus anciennes que quelques dizaines de milliers d'années car après cela tout le
ne cesse de décroître par désintégration. La mesure du rapport permet de déterminer à quelle date l'être vivant est mort. Cela est très utilisé pour déterminer l'âge des momies. Cette méthode ne peut permettre des datations plus anciennes que quelques dizaines de milliers d'années car après cela tout le 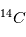 est désintégré.
est désintégré.
Les atomes sont par définition neutres, cependant des réactions chimiques peuvent faire qu'un atome gagne ou perde un électron. L'atome résultant devient un ion, négatif s'il a gagné un électron, positif s'il en a perdu un. Étant chargé, un ion aura tendance à fortement interagir avec une autre particule chargée de signe contraire pour reformer un élément neutre ; un atome ou une molécule.