Les isotopes |
Nous avons vu que les atomes sont des systèmes électriquement neutres, et leur noyau ont une charge électrique 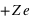 liée à leur nombre
liée à leur nombre 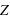 de protons de charge électrique
de protons de charge électrique 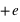 . Ainsi ajouter ou enlever des neutrons de charge électrique nulle dans le noyau atomique ne changera pas la neutralité de l'atome. Les noyaux ayant le même nombre de protons, mais un nombre différent de neutrons sont appelés des isotopes.
. Ainsi ajouter ou enlever des neutrons de charge électrique nulle dans le noyau atomique ne changera pas la neutralité de l'atome. Les noyaux ayant le même nombre de protons, mais un nombre différent de neutrons sont appelés des isotopes.
Le nombre de nucléons est designé par 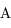 , dans la notation d'un élément
, dans la notation d'un élément 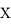 de matière (
de matière (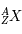 ) le nombre de neutrons est alors (
) le nombre de neutrons est alors (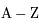 ). Par exemple, le noyau d'hydrogène 1H a trois isotopes principaux :
). Par exemple, le noyau d'hydrogène 1H a trois isotopes principaux : 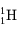 (0 neutron), le deutérieum
(0 neutron), le deutérieum 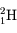 (1 neutron) et le tritium
(1 neutron) et le tritium 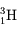 (2 neutrons), le noyau de carbone a quatre isotopes principaux :
(2 neutrons), le noyau de carbone a quatre isotopes principaux : 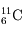 (5 neutrons),
(5 neutrons), 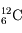 (6 neutrons),
(6 neutrons), 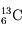 (7 neutrons) et
(7 neutrons) et 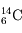 (8 neutrons).
(8 neutrons).