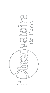 |
|
|
||||||||||||||
|
|
||||||||||||||
 Gli atomi d’idrogeno
Gli atomi d’idrogeno
 |
Il modello “classico” dell’ atomo d’idrogeno è un elettrone in orbita intorno al nucleo, composto soltanto da un protone.
Gli elettroni si trovano a delle distanze precise del nucleo. Allo stato fondamentale (n=1), l’orbita dell’ elettrone ha un raggio di 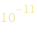 metri (raggio classico di Bohr). L’elettrone puo anche essere su orbite più grandi, associate a dei numeri interi n = 2, 3, 4...n = ∞
metri (raggio classico di Bohr). L’elettrone puo anche essere su orbite più grandi, associate a dei numeri interi n = 2, 3, 4...n = ∞
Il nucleo ha un raggio di 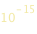 metri. L’atomo allo stato fondamentale è 10000 volte più grosso del nucleo. Se il nucleo avesse le dimensioni di una moneta da dieci centesimi, l’atomo avrebbe le dimensioni di un campo da calcio.
metri. L’atomo allo stato fondamentale è 10000 volte più grosso del nucleo. Se il nucleo avesse le dimensioni di una moneta da dieci centesimi, l’atomo avrebbe le dimensioni di un campo da calcio.
L’atomo puo passare dallo stato fondamentale (n=1) a uno stato eccitato assorbendo un fotone di luce. Puo anche tornare al suo stato fondamentale emettendo della luce il cui colore (lunghezza d’onda) dipenderà dai livelli d’energia del atomo.
Il passagio dal livello n2 al livello n1 corrisponde a un emissione/assorbimento di lunghezza d’onda 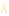 , tale che
, tale che
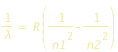 , con
, con 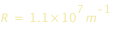
Se l’atomo riceve sufficiente energia , l’elettrone passa dal livello n=1 al livello infinito. L’atomo perde il suo elettrone e diventa uno ione. La lunghezza d’onda corrispondente è 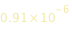 m cioè nella regione UV dello spettro elettromagnetico.
m cioè nella regione UV dello spettro elettromagnetico.
Nell’atmosfera di una stella, gli atomi d’idrogeno, illuminati dalla stella, assorbono unicamente i colori che li fanno passare da un livello ad un altro.