
De l'UV à l'IR (1/2) |
Le rayonnement thermique donne un spectre continu. Cependant, si nous regardons attentivement le spectre solaire, nous nous apercevons qu'il est parsemé de stries noires. Elles sont appelées "raies d'absorption" car elles correspondent à l'absorbtion du rayonnement (le fond continu) par des atomes présents (principalement) dans l'atmosphère du Soleil.

L'état énergétique d'un atome, d'un ion ou d'une molécule n'est pas continu mais quantifié. Un atome passe d'un niveau d'énergie à un autre par palier (par la suite nous ne parlerons que d'atome pour ne pas alourdir le texte mais ce qui est décrit s'applique également aux ions et aux molécules). Un atome absorbe (ou émet) de l'énergie correspondant à chaque saut de palier. Ainsi, un photon qui possède une énergie exactement égale à un saut énergétique d'un atome donné sera absorbé.
Chaque atome possède une "carte énergétique" propre : les sauts autorisés pour le fer par exemple ne sont pas ceux du carbone ou de l'hydrogène. Ainsi, la position de ces raies d'absorption permettent de connaître les éléments présents dans l'atmosphère solaire. La "carte énergétique" d'un atome est connue par les physiciens atomistes.
L'hélium a ainsi été découvert sur le Soleil avant d'être trouvé sur Terre, d'où son nom !
Les atomes ayant absorbé de l'énergie sont dits excités. Ils ne resteront pas dans cet état pour une longue durée. Ils vont se désexciter en retombant directement ou par paliers successifs dans un état énergétique plus stable. Ce faisant, ils vont émettre des photons (paquets d'onde électromagnétique) correspondants à ce(s) saut(s) énergétique(s). Autrement dit, un atome peut émettre un photon à la même énergie qu'il peut en absorber. La longueur d'onde d'émission (d'absorption) est directement liée au saut énergétique franchi :
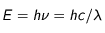
avec h la constante de Planck, c la vitesse de la lumière, 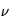 la fréquence et
la fréquence et 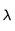 la longueur d'onde. Ainsi, plus la longueur d'onde est grande (fréquence petite) plus l'énergie du photon est petite.
la longueur d'onde. Ainsi, plus la longueur d'onde est grande (fréquence petite) plus l'énergie du photon est petite.
Nous avons vu le processus d'émission et d'absorption de la lumière par un atome en l'appliquant dans le domaine visible du spectre solaire. Mais le phénomène conduit également à des l'absorption et de l'émission dans l'infrarouge ou l'ultraviolet.