Détection du gaz atomique: L'atome d'hydrogène |
Le noyau de l'atome d'hydrogène est constitué d'un seul proton autour duquel ne tourne qu'un seul électron sur des orbites bien définies appelées niveaux d'énergie. L'énergie de l'électron sur une orbite donnée dépend du nombre quantique principal 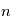 (il prend des valeurs entières) du niveau selon la relation:
(il prend des valeurs entières) du niveau selon la relation: 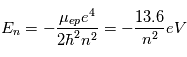 , où
, où 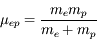 est la masse réduite du système électron-proton. Le niveau fondamental d'énergie minimale,
est la masse réduite du système électron-proton. Le niveau fondamental d'énergie minimale, 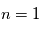 , est situé à une énergie de -13.6 eV sous la limite d'ionisation
, est situé à une énergie de -13.6 eV sous la limite d'ionisation 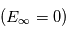 . Lorsque
. Lorsque 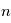 augmente, l'énergie du niveau est de moins en moins négative : elle augmente. Le niveau
augmente, l'énergie du niveau est de moins en moins négative : elle augmente. Le niveau 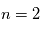 est ainsi situé à -3.4 eV sous la limite d'ionisation
est ainsi situé à -3.4 eV sous la limite d'ionisation 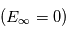 , c'est-à-dire à +10.2 eV au dessus du fondamental. Afin de minimiser l'énergie du système, les électrons sur des orbites excitées vont se désexciter radiativement spontanément vers des niveaux de valeur de
, c'est-à-dire à +10.2 eV au dessus du fondamental. Afin de minimiser l'énergie du système, les électrons sur des orbites excitées vont se désexciter radiativement spontanément vers des niveaux de valeur de 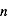 plus faible. Les cascades radiatives des niveaux supérieurs vers le niveau
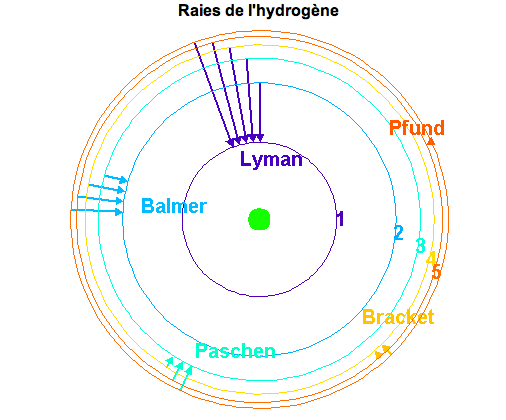
plus faible. Les cascades radiatives des niveaux supérieurs vers le niveau 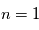 produisent un ensemble de raies spectrales dans l'ultraviolet dénommé Série de Lyman, celles vers le niveau
produisent un ensemble de raies spectrales dans l'ultraviolet dénommé Série de Lyman, celles vers le niveau 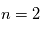 créent des raies dans le visible correspondant à la Série de Balmer. Enfin, les cascades vers les niveaus
créent des raies dans le visible correspondant à la Série de Balmer. Enfin, les cascades vers les niveaus 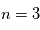 , 4 et 5 donnent les Séries de Paschen, Bracket et Pfund dans l'infrarouge (voir Figure ci-dessous). Ces cascades se produisent lorsqu'un proton et un électron se recombinent pour reformer un atome neutre, car la recombinaison se fait en général sur un état excité. Ces raies dites "de recombinaison" sont donc une signature de régions où l'hydrogène subit une certaine ionisation (par rayonnement ou par collisions).
, 4 et 5 donnent les Séries de Paschen, Bracket et Pfund dans l'infrarouge (voir Figure ci-dessous). Ces cascades se produisent lorsqu'un proton et un électron se recombinent pour reformer un atome neutre, car la recombinaison se fait en général sur un état excité. Ces raies dites "de recombinaison" sont donc une signature de régions où l'hydrogène subit une certaine ionisation (par rayonnement ou par collisions).
Dans le cas non relativiste, un état de nombre quantique 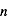 est constitué de
est constitué de 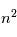 sous-niveaux d'énergie identique. Chaque sous-niveau est caractérisé par un nombre quantique
sous-niveaux d'énergie identique. Chaque sous-niveau est caractérisé par un nombre quantique 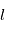 , qui correspond dans le cas classique à l'amplitude du moment orbital angulaire de l'électron, et par un nombre quantique
, qui correspond dans le cas classique à l'amplitude du moment orbital angulaire de l'électron, et par un nombre quantique 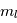 qui équivaut à la projection du moment angulaire orbital sur l'axe de rotation.
qui équivaut à la projection du moment angulaire orbital sur l'axe de rotation. 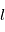 ne peut prendre que les valeurs entières entre 0 et
ne peut prendre que les valeurs entières entre 0 et 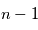 , et
, et 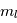 celles entre
celles entre 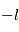 et
et 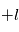 (on dit que le moment orbital est quantifié). L'électron possède aussi un moment cinétique intrinsèque qui n'a pas d'équivalent classique, le spin, lui aussi quantifié comme le moment angulaire orbital. L'interaction dite de structure fine entre le moment orbital
(on dit que le moment orbital est quantifié). L'électron possède aussi un moment cinétique intrinsèque qui n'a pas d'équivalent classique, le spin, lui aussi quantifié comme le moment angulaire orbital. L'interaction dite de structure fine entre le moment orbital 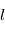 de l'électron et son spin induit la levée de dégénérescence des
de l'électron et son spin induit la levée de dégénérescence des 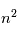 niveaux qui prennent alors des énergies faiblement différentes. Cette décomposition disparaît quand
niveaux qui prennent alors des énergies faiblement différentes. Cette décomposition disparaît quand 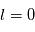 . Le proton possède également un moment cinétique de spin qui se combine avec le spin de l'électron en produisant une sous-structure encore plus fine des niveaux, dite hyperfine. En équivalent classique, l'énergie de l'atome dépend de si le spin de l'électron et du proton sont parallèles (configuration ortho) ou antiparallèles (configuration para).
. Le proton possède également un moment cinétique de spin qui se combine avec le spin de l'électron en produisant une sous-structure encore plus fine des niveaux, dite hyperfine. En équivalent classique, l'énergie de l'atome dépend de si le spin de l'électron et du proton sont parallèles (configuration ortho) ou antiparallèles (configuration para).
Dans le MIS froid, seul le niveau fondamental 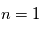 de l'hydrogène est peuplé, où
de l'hydrogène est peuplé, où 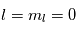 . Il n'y a donc pas de raie de structure fine, seulement une raie de structure hyperfine : la raie à 21 cm dont nous parlons plus en détail ci-dessous.
. Il n'y a donc pas de raie de structure fine, seulement une raie de structure hyperfine : la raie à 21 cm dont nous parlons plus en détail ci-dessous.